Class 10 Physical Science Model Activity Task February 2022
দশম শ্রেণী (Class – X)ভৌতবিজ্ঞান
১. ঠিক উত্তর নির্বাচন করো :
১.১. SATP বলতে যে উষ্ণতা বোঝায় তার মান নিকটতম পূর্ণসংখ্যায় –
(ক) 263K
(খ) 273K
(গ) 298K
(ঘ) 373K
উত্তর - 298K
১.২. $PV=\frac{W}{M}RT$ সমীকরণে (চিহ্নগুলি প্রচলিত অর্থ বহন করে) 'M' রাশির একক হল -
(ক) g
(খ) g mol
(গ) g/mol
(ঘ) mol-1
উত্তর - g/mol
১.৩ কোনো আদর্শ গ্যাসের ক্ষেত্রে স্থির উষ্ণতা ও স্থির ভর হলে বয়েলের সূত্রানুসারে চাপ ও আয়তনের লেখচিত্রটি হবে-
(ক) মূলবিন্দুগামী সরলরেখা
(খ) উপবৃত্তের অংশ
(গ) পরাবৃত্তের অংশ
(ঘ) আয়তনের অক্ষের সমান্তরাল সরলরেখা
উত্তর - পরাবৃত্তের অংশ
২. নীচের বাক্যগুলি সত্য অথবা মিথ্যা তা নিরূপণ করো :
২.১ একটি গ্যাস অণুর আয়তন = (গ্যাস দ্বারা অধিকৃত আয়তন ÷ গ্যাস অণুর সংখ্যা)
উত্তর - সত্য ।
২.২. ${}^{12}C$= 12.0000 u-এর পরিবর্তে অন্য কোনো সাংখ্যমান ধরা হলেও STP-তে কোনো গ্যাসের মোলার আয়তন একই থাকবে।
উত্তর - মিথ্যে ।
২.৩ নির্দিষ্ট উষ্ণতা ও চাপে দুটি আদর্শ গ্যাসের আয়তন অনুপাত গ্যাসদুটির মোল সংখ্যার অনুপাতের সমান।
উত্তর - সত্য ।
৩. সংক্ষিপ্ত উত্তর দাও :
৩.১ মাত্রীয় বিশ্লেষণ থেকে গ্যাস ধ্রুবক "R"-এর একক কী হওয়া উচিত তা দেখাও।
উত্তর - আমরা জানি, n মোল কোনো গ্যাসের ক্ষেত্রে অবস্থার সমীকরণটি হল,
PV = nRT
যেখানে, P = চাপ, V = আয়তন, R =সার্বজনীন গ্যাস ধ্রুবক, T = পরম উষ্ণতা
বা, $R\text{ }=\text{ }\frac{PV}{nT}$
R এর মাত্রা = P এর মাত্রা × V এর মাত্রা / n
এর মাত্রা × T এর মাত্রা
= $\frac{\left[ ML-1T-2 \right]\text{ }x\text{ }\left[ L3 \right]}{\left[ Mol \right]\text{ }x\text{ }\left[ K \right]}$
=$\left[ M{{L}^{-1}}{{T}^{-2}}\text{ }mo{{l}^{-1}}\text{ }{{K}^{-1}}\text{ } \right]$
= শক্তির মাত্রার × $\left[ mo{{l}^{-1}}\text{ }{{k}^{-1}} \right]$
= R এর একক হল -
CGS : পদ্ধতিতে $erg.mo{{l}^{-1}}.\text{ }{{K}^{-1}}$
SI: পদ্ধতিতে J. mol-1. K-1
৩.২ প্রধানত কোন কোন কারণে বাস্তব গ্যাসগুলি আদর্শ আচরণ থেকে বিচ্যুত হয়?
উত্তর - 1873 খ্রিস্টাব্দে বিজ্ঞানী ভ্যানডার ওয়ালস বাস্তব গ্যাস আদর্শ আচরণ থেকে বিচ্যুতির কারণ হিসেবে গ্যাসের গতীয় তত্ত্বের দুটি ত্রুটি উল্লেখ করেন।(i) আয়তন সংক্রান্ত ত্রুটি (ii) চাপ সংক্রান্ত ত্রুটি|
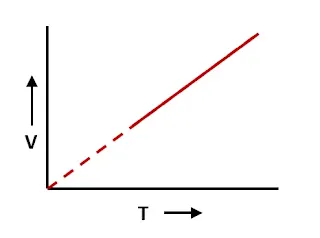
৩.৩. স্থির চাপে স্থির ভরের আদর্শ গ্যাসের ক্ষেত্রে V - t ও V - T লেখচিত্র কেমন হবে এঁকে দেখাও।
উত্তর -
স্থির চাপে স্থির ভরের আদর্শ গ্যাসের ক্ষেত্রে V – t লেখচিত্র
স্থির চাপে স্থির ভরের আদর্শ গ্যাসের ক্ষেত্রে V – T লেখচিত্র
উত্তর - শুষ্ক বায়ু অপেক্ষা আর্দ্র বায়ু হালকা: শুষ্ক বায়ুতে অন্যান্য অনেক গ্যাস থাকলেও মূলত N2 ও O2 এর প্রাধান্য বেশি থাকে। মোটামুটিভাবে শুষ্ক বায়ুতে 4 ভাগ N2 ও1 ভাগ O2 আছে।
N2 এর মোলার ভর $28g.mo{{l}^{-1}}$। O2 এর মোলার ভর $32g.mo{{l}^{-1}}$ হওয়ায় শুষ্ক বায়ুর গড় গ্রাম আণবিক ভর $\frac{\left( 28\times 4+32\text{ }x\text{ }1\text{ } \right)\text{ }}{\left( 4+1 \right)}$ = 28.8g । আবার, জল বা জলীয় বাষ্পের (H20) মোলার ভর = (1 x 2 +16) = $18g.mo{{l}^{-1}}$। সুতরাং জলীয় বাষ্প, শুষ্ক বায়ু অপেক্ষা হালকা তাই বাতাসে জলীয় বাষ্প থাকলে অর্থাৎ বায়ু আর্দ্র হলে তার গড় আণবিক ভর, শুষ্ক বায়ুর গড় আণবিক ভরের চেয়ে কম হয়। তাই শুষ্ক বায়ু অপেক্ষা আর্দ্র বায়ু লঘু বা হালকা।
৪. নীচের প্রশ্ন দুটির উত্তর দাও :
৪.১ একটি আদর্শ গ্যাসের মধ্যে কিছু ধূলিকণা রয়েছে (ধূলিকণা চাপে অনমনীয়)। উষ্ণতায় স্থির রেখে গ্যাসের চাপ দ্বিগুণ করা হলে ধূলিকণাসহ গ্যাসের আয়তন 1000 mL থেকে কমে 500.25 mL হয়। ধূলিকণার সামগ্রিক আয়তন নির্ণয় করো।
উত্তর - ধরি গ্যাসের প্রাথমিক চাপ P,
প্রাথমিক আয়তন(ধূলিকণর আয়তন V ) = (1000+V)mL,
গ্যাসের অন্তিম চাপ 2P,
এবং অন্তিম আয়তন 500.25mL,
যেহেতু উষ্ণতা স্থির তাই বয়েলের সূত্র অনুসারে, ${{P}_{1}}{{V}_{1}}\text{ }=\text{ }{{P}_{2}}{{V}_{2}}$
বা, P(1000 + V) = 2P x 500.25
বা, 1000 + V = 2 x 500.25
বা, 1000 + V = 1000.50
বা, V=1000.50-1000
বা, V= 0.50 mL
৪.২. 760 mm Hg চাপে 0°C উষ্ণতায় 3.2 g যে গ্যাসের আয়তন 2.24 L তার গ্রাম আণবিক ওজন নির্ণয় করো। সাধারণ হাইড্রোজেনের অণু অপেক্ষা গ্যাসের একটি অণু কতগুণ ভারী?
উত্তর - প্রশ্নানুসারে,
চাপ (P) = 760 mm Hg 760/760 = 1 atm
উষ্ণতা (T)=0° C=(0+273)K=273 K
গ্যাসের ভর (W) = 3.2 g
গ্যাসের আয়তন (V) = 2.24 L
আণবিক ওজন (M) = ?
সার্বজনীন গ্যাস ধ্রুবক (R)
=0.082 $L\text{ }\text{.}atm.mo{{l}^{-1}}.{{K}^{-1}}$
আমরা জানি, $PV\text{ }=\text{ }\frac{W\text{ }}{M}RT$
$\therefore \quad M\text{ }=\text{ }\frac{WRT}{PV}$
= $\frac{3.2\times 0.082\times 273\text{ }}{1\text{ }\times 2.24}$
= $\frac{71.63\text{ }}{2.24}$g · mol-1
= 31.98 g · mol-1
$\therefore $ গ্যাসটির গরম আণবিক ওজন 31.98 g · mol-1